李智慧主任:CD7 CAR-T桥接异基因移植可显著改善R/R T-ALL/LBL患者长期无病生存
2024-12-11急性T淋巴细胞白血病(T-ALL)是一种高度异质性的血液系统恶性疾病,约占儿童和成人所有病例的25%~50%。T-ALL本身的遗传多样性一定程度上限制了该领域靶向治疗和免疫治疗的发展,使临床治疗面临诸多困难,复发/难治性急性T淋巴细胞白血病/T淋巴母细胞淋巴瘤(R/R T-ALL/LBL)患者预后更不理想。
近日,高博医疗集团北京高博博仁医院吴彤主任团队的李智慧主任团队于Transplantation and Cellular Therapy期刊发文,聚焦R/R T-ALL/LBL的诊疗困境探讨了在北京博仁医院接受CD7 CAR-T桥接异基因造血干细胞(allo-HSCT)治疗的R/R T-ALL/LBL患者的长期结局,证实了这一联合策略能够提高该患者群体的长期无病生存。
与B系血液肿瘤相比,T系血液肿瘤的CAR-T治疗相当具有挑战,此前,吴彤主任、李智慧主任团队探索CD7 CAR-T桥接allo-HSCT治疗T系血液肿瘤的相关成果已多次登上美国血液学年会(ASH)、欧洲血液学年会(EHA)等国际学术舞台,连续多年向全球同道分享博仁医生团队在T系CAR-T领域的宝贵经验。
研究摘要
这项回顾性研究纳入了2018年2月~2023年1月在北京高博博仁医院接受治疗的90例R/R T-ALL/LBL患者(40例R-ALL,50例T-LBL)。患者的中位年龄为14(范围:2-65)岁。
所有患者在移植前都接受过化疗,移植前治疗的中位线数位4(范围:1-7)。32例(35.6%)患者对化疗敏感,移植前达到CR(CR组);58例(64.4%)患者对化疗耐药,移植前未缓解(NR)。其中,41例NR患者在接受allo-HSCT前接受了CD7 CAR-T(CAR-T组)治疗, 17例NR患者接受挽救性移植(NR组)。
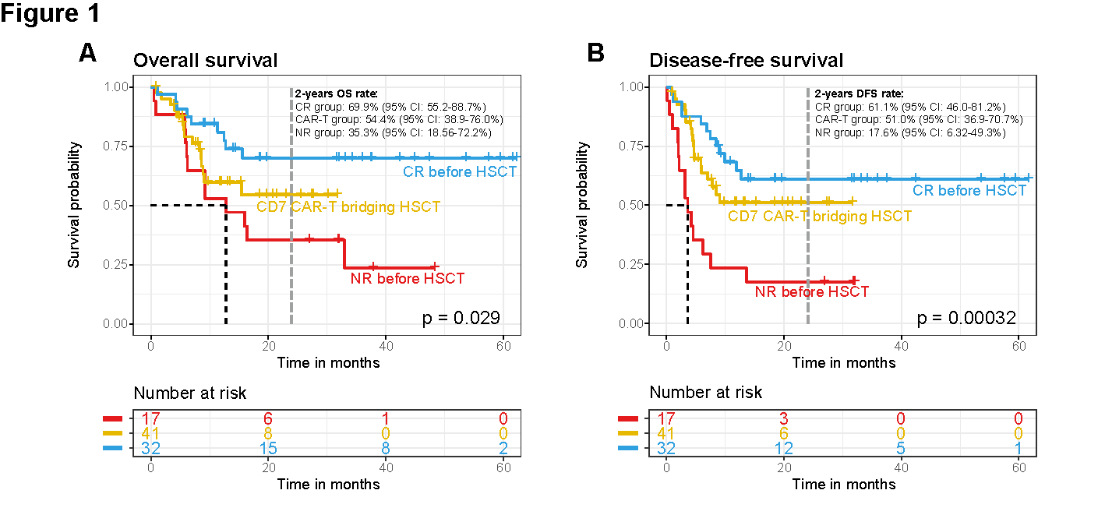
中位随访25.5(95% CI: 19.6-32)个月,CAR-T组的总生存(OS)率和无病生存(DFS)率与CR组相似,且优于NR组。2年OS分别为54.4%、69.9%和35.3%,2年DFS分别为51.0%、61.1%和17.6%。1年后CAR-T组和CR组的累积复发率显著低于NR组:31.67%、29.0%和70.5%。此外,治疗相关死亡率分别为17.29%、9.8%和11.76%(p=0.65)。
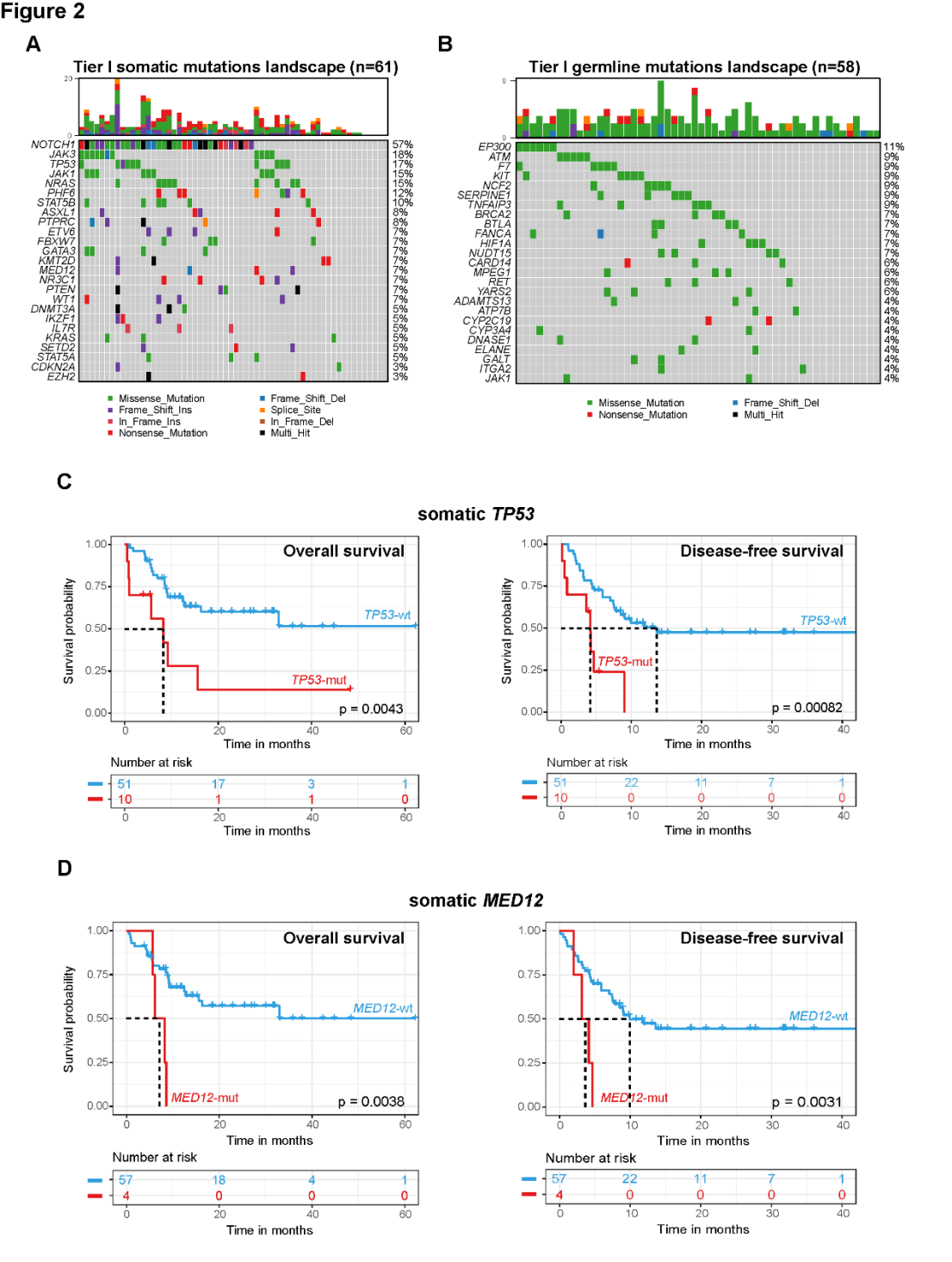
在移植前,本研究通过NGS检测T-ALL/LBL患者的体细胞和胚系基因突变,结果显示TP53和MED12突变与移植后较高的复发和死亡率显著相关。
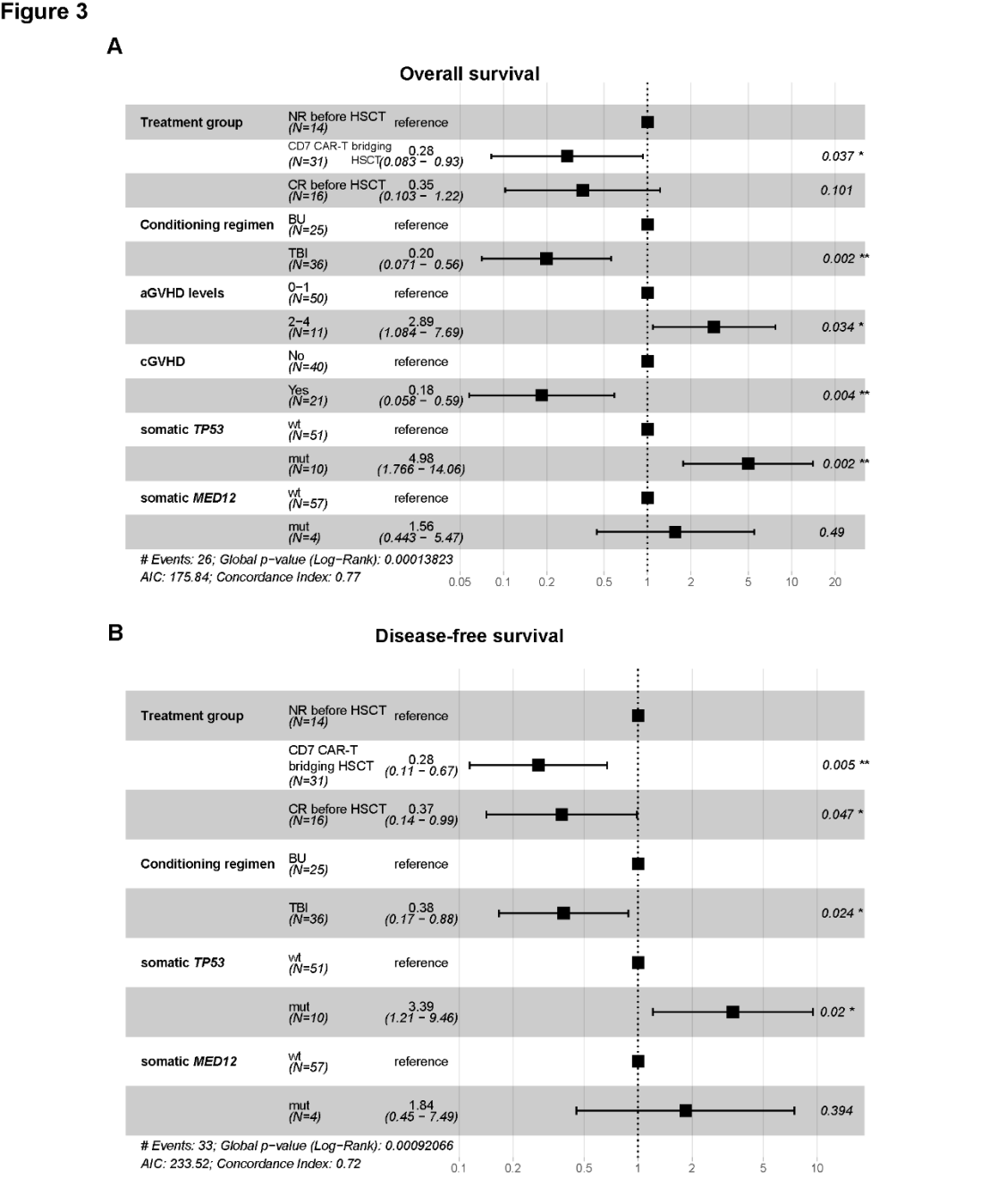
但多因素分析表明,MED12突变不影响OS(p=0.49)或DFS(p=0.394)。
研究结论
该项回顾性研究表明,CD7 CAR-T桥接allo-HSCT能够显著改善化疗耐药T-ALL/LBL患者的长期DFS,并获得了与化疗CR组相当的安全性和有效性。CD7 CAR-T(p=0.037)、TBI预处理(p=0.002)和cGVHD(p=0.004)是OS的独立保护因素,而aGVHD(p=0.034)和TP53突变(p=0.002)是OS的独立风险因素。CD7 CAR-T(p=0.005)和TBI预处理(p=0.024)对DFS是保护因素,TP53突变(p=0.02)对DFS是风险因素。与此同时,研究还揭示了R/R T-ALL/LBL患者体细胞和胚系基因突变的概况,并初步确定影响移植结局的基因突变因素。










