近年来,免疫治疗逐渐成为引领结直肠癌(CRC)治疗革新的重要创新手段之一,尤其是在转移性微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR)结直肠癌患者这一免疫治疗优势人群中,但在当前 PD-1 单药标准治疗下,MSI-H/dMMR 仍存在未满足的需求。2025 年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)大会上,全球首个探索纳武利尤单抗联合伊匹木单抗在 MSI-H/dMMR mCRC 患者中作用的确证性 Ⅲ 期研究——CheckMate-8HW 更新重磅数据,首次证实双免治疗获益显著优于单免治疗,进一步明确了前者的全新标准治疗地位,为结直肠癌患者的「肠」安之路再添新机。该研究的中国主要研究者、高博医疗集团上海高博肿瘤医院李进教授将围绕 MSI-H/dMMR CRC 治疗领域进展、CheckMate-8HW 研究数据和临床启示,以及 CRC 治疗未来发展前景等热点问题分享观点和经验。
1、最近几年结直肠癌治疗领域发展很快,尤其是 MSI-H/dMMR 类型患者的治疗,您能不能介绍下这一类患者的治疗取得了哪些进展?
MSI-H/dMMR 型 CRC 患者目前占全部 CRC 患者的 5% 左右,该类型属于 CRC 中的特殊群体,治疗手段和错配修复完整(pMMR)CRC 患者不同,具体表现为对于免疫治疗较为敏感。
具体在 mCRC 领域中,CheckMate-142 研究初步探索了双免疫方案是否可为 MSI-H/dMMR 患者带来良好疗效和长期生存。结果显示,纳武利尤单抗联合伊匹木单抗(O + Y)一线治疗的客观反应率(ORR)高达 71%,且毒性较低,和化疗相比具有优势。在此基础上,确证性 CheckMate-8HW 研究应运而生。结果显示,「O + Y」双免疗法用于 MSI-H/dMMR mCRC 患者一线治疗疗效卓越,和化疗相比可显著降低患者疾病进展或死亡风险,结果令人振奋。同时方案显示出良好的安全性,为 MSI-H/dMMR 患者提供了非常有效且毒性可耐受的治疗选择。
2、CheckMate-8HW 研究对晚期结直肠癌患者特别重要。作为该研究的中国主要研究者,您能否介绍一下它的具体数据?这些数据反映了双免方案在作用机制上的哪些优势?
很荣幸作为研究的中国主要研究者来共同参与CheckMate-8HW 研究的开展。CheckMate-8HW 是一项在 MSI-H/dMMR mCRC 患者中开展的随机、多中心、开放标签 Ⅲ 期临床研究,旨在 MSI-H/dMMR mCRC 患者中评估「O + Y」双免对比免疫单药(O),或比化疗方案的疗效与安全性,主要终点为经盲态独立中心审查(BICR)评估的双免对比化疗(一线),及双免对比单免(所有治疗线)的无进展生存期(PFS)(图 1)。
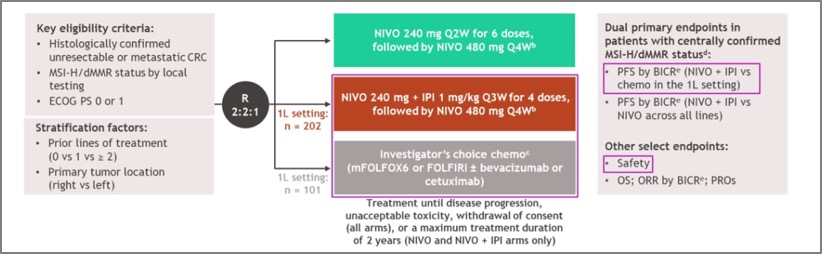
图 1. CheckMate-8HW 研究设计
从 2024 年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)会议公布的数据来看,双免组的中位 PFS 尚未达到(NR),而化疗组仅为 5.9 个月,「O + Y」双免方案将疾病进展或死亡风险显著降低 79%(HR 0.21,95% CI 0.13~0.35,P < 0.0001),两组 2 年 PFS 率分别是72% vs 14%(图 2)。这是首次在 Ⅲ 期研究中证实双免疫联合疗法对比标准化疗在 MSI-H/dMMR mCRC 一线治疗中可为患者带来显著临床获益,展现了双免方案巨大的临床应用潜力。
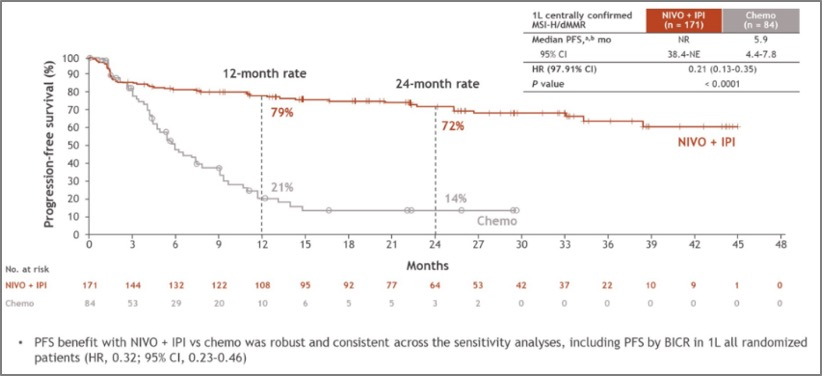
图 2. O + Y 双免治疗组与化疗组 24 个月时的 PFS 结果
2025 年 ASCO GI 会议进一步公布了双免方案「O + Y」和免疫单药「O」的对比结果,数据显示研究最短随访时间为 16.7 个月,两组的中位 PFS 分别是 NR vs 39.3 个月,「O + Y」双免组将疾病进展或死亡风险降低 38%(HR 0.62,95% CI 0.48~0.81,P = 0.0003)(图 3)。最新数据中,「O + Y」双免组的 ORR 也得到显著提升,两组分别为 71% vs 58%(P = 0.0011),数据结果令人震撼。
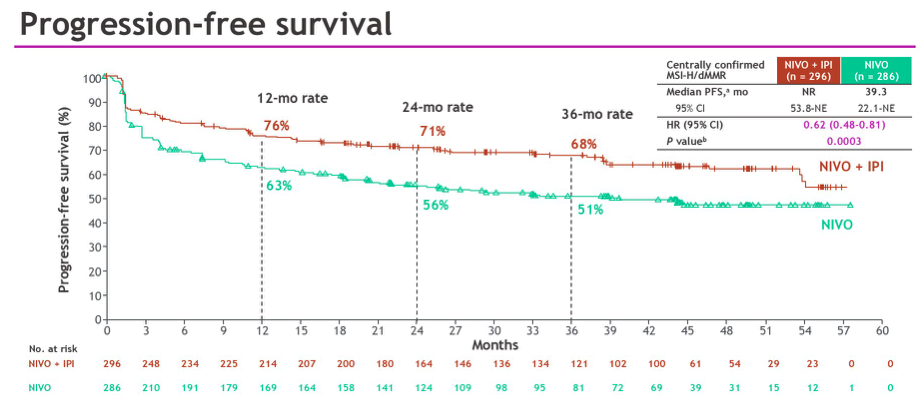
图 3.「O + Y」双免治疗对比免疫单药「O」队列 PFS 结果
基于 CheckMate-8HW 研究的优异成果,2024 年 10 月,中国国家药品监督管理局(NMPA)批准「O + Y」双免方案治疗晚期 MSI-H/dMMR CRC 的一线适应证。值得注意的是,这是全球范围内双免方案在该适应证上的首次批准,显示出我国药品审评审批的开放性和前沿性,体现以患者为中心的理念。
CheckMate-8HW 研究取得如此卓越的结果,与双免协同作用机制密不可分。从肿瘤免疫调控机制来说,CTLA-4 主要作用于免疫细胞激活的早期阶段。CTLA-4 表达于树突细胞(DC)和调节 T 细胞(Treg)表面,抑制 T 细胞的过强活化和增殖。抑制 CTLA-4 通路后,CD8 阳性 T 细胞可大幅增殖、活化;而 PD-1 作用于免疫反应的晚期阶段,可结合于 T 细胞表面的 PD-L1,阻断 T 细胞和肿瘤细胞结合,从而恢复增殖、活化后的T细胞对肿瘤的识别,促进其对肿瘤细胞的杀伤。因此,CTLA-4 和 PD-1 的抑制剂联合应用可协同增效,具有高效持久的抗肿瘤作用。
3、之前的研究已经显示双免方案整体安全性可耐受。结合 CheckMate-8HW 研究最新的安全性数据,您认为临床医生在使用联合免疫方案时应注意哪些要点?
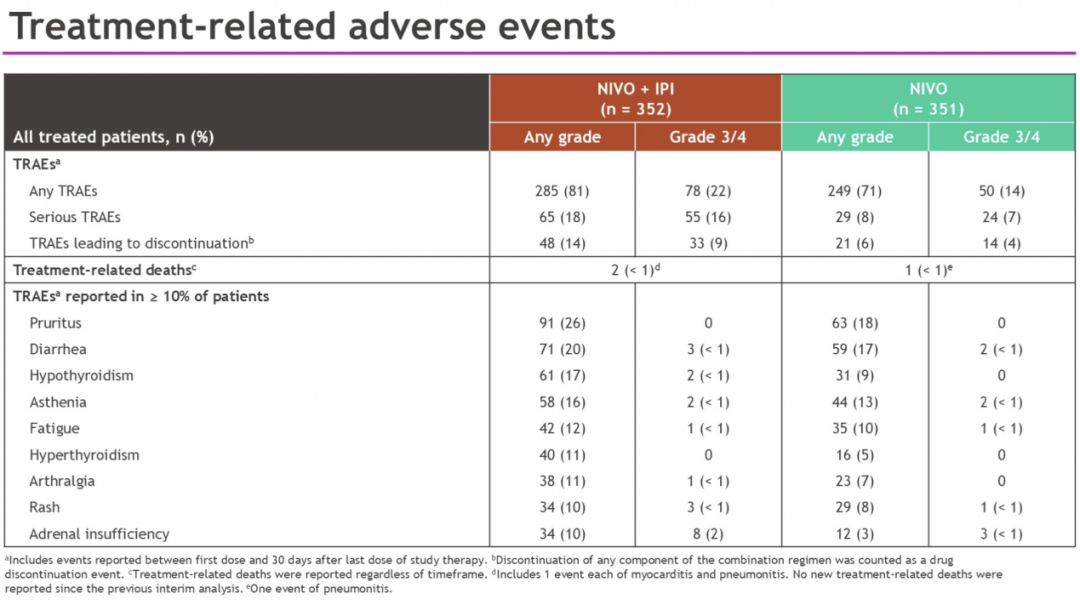
在安全性方面,CheckMate-8HW 研究显示「O + Y」双免方案的安全性良好,未发现新的安全信号。2024 年 ASCO GI 报道数据显示双免方案的 3/4 级治疗相关不良事件(TRAE)发生率低于化疗,两组分别为 23% vs 48%。2025 年 ASCO GI 报道数据中,「O + Y」双免组显示出与免疫单药治疗组一致的可控安全性,两组 3/4 级 TRAE 发生率分别为 22% vs 14%,未发现新的安全性信号。双免组 3/4 级治疗 TRAE 发生率与 2024 年公布的双免对比化疗的安全性数据相似(表 1)。
表 1.「O + Y」双免治疗组与免疫单药组治疗相关 AEs
而在实际的临床应用中,临床医生则需要科学地应对不良反应。在临床应用时应首先注意预防,通过基线检查识别高危因素,预测哪些患者可能会发生免疫相关不良事件(irAE)。其次,做好患者教育,强调临床症状以早期发现、早期报告 irAE。此外,治疗过程中需要密切观察和动态随访,关注新发症状,做好诊断和鉴别诊断,以早期发现 irAE,并避免严重 irAE 的发生。一旦发生 irAE,应及时评估分级,根据不同分级采用相应干预策略,通过使用激素、降低剂量等措施进行治疗。
4、现在「O + Y」双免疫方案主要用于晚期结直肠癌,您认为这一方案在结直肠癌中还有哪些值得探索的方向?
目前在 CRC 领域,对新辅助治疗的探索正在不断深入。特别是直肠癌患者涉及保器官的治疗目的,在保证疗效的基础上是否可以豁免手术或缩小手术范围始终是临床中关注的热点。如果通过药物治疗使病灶显著缩小,同时通过放疗等局部手段进行辅助,达到完全缓解则有望实现保留器官。NICHE-2 研究已经显示出双免方案用于新辅助治疗,在病理缓解方面的优异结果,该研究探索了 dMMR 局部晚期结直肠癌患者接受「O + Y」双免新辅助治疗的疗效,3 年随访结果显示主要病理缓解(MPR)率达到 95%,病理完全缓解(pCR)率达到 68%,3 年无病生存(DFS)率高达 100%。由此可见,未来可能大多数 dMMR 患者不需要手术,有望通过免疫等治疗方案实现保器官、保功能的治疗目的,使患者享受到先进治疗带来的多方面获益。
此外,关注占 CRC 人群绝大多数的 pMMR 患者也是十分必要的。此类患者接受化疗联合靶向治疗的有效率为 50% 左右,中位 PFS 约 8~10 个月。在这类患者中,化疗基础上联合双免疫方案是否可进一步提升疗效?应在何种情况下联合双免疫方案?这些问题仍有待探索。未来,我们期待更多高质量研究深入攻坚,为患者带来更优的治疗策略。
总结
「O + Y」双免方案令人惊艳的整体疗效和广泛的获益人群,将患者获益提升到新的高度,同时也重塑了 mCRC 治疗格局,有望树立 MSI-H/dMMR mCRC 一线治疗新标准。未来,期待双免治疗联合疗法在结直肠癌不同治疗阶段以及更多肿瘤类型的治疗中持续深入探索,并累积更多真实世界数据,为广大肿瘤患者带来更大获益。




















