2025年6月1日,由沈琳教授团队设计主导的全球首个CLDN18.2 CAR-T胃癌随机对照研究,“Claudin-18 isoform 2-specific CAR T-cell therapy (satri-cel) versus treatment of physician’s choice for previously treated advanced gastric or gastro-oesophageal junction cancer (CT041-ST-01): a randomised, open-label, phase 2 trial”的阳性结果正式发布于国际权威学术期刊《柳叶刀》(The Lancet)(IF=168.9),并由第一作者齐长松教授同步在2025年美国临床肿瘤学会(ASCO)进行大会口头报告,引起广泛关注。

6月3日,该研究结果也登上了Nature官网头条。
CT041-ST-01研究(NCT04581473)是全球首个针对实体瘤的CAR-T疗法随机对照临床试验,旨在评估Claudin18.2特异性CAR-T细胞治疗——Satricabtagene autoleucel (satri-cel)/舒瑞基奥仑赛注射液,相较于研究者选择治疗(TPC)在既往治疗失败的晚期胃癌或胃食管结合部癌(G/GEJC)患者中的疗效与安全性。
研究背景
CLDN18.2在多种消化道肿瘤中存在过表达,尤其对于G/GEJC,已成为该领域极具潜力的治疗靶点。舒瑞基奥仑赛(satri-cel)作为一种自体CLDN18.2特异性CAR-T细胞疗法,在既往治疗失败的晚期G/GEJC患者中开展的I期临床试验展现出令人鼓舞的疗效,沈琳教授团队已在2024年6月于《自然-医学》(Nature Medicine)发表了突破性结果(Qi, C. et al.Nat. Med. 2024. doi: 10.1038/s41591-024-03037-z),该研究为CAR-T疗法在实体瘤领域的深入探索提供了关键科学依据。基于上述研究结果,由沈琳教授团队设计主导了舒瑞基奥仑赛(satri-cel)在CLDN18.2表达阳性、至少二线治疗失败的晚期G/GEJC患者的确证性II期研究。
研究设计
本次II期研究是一项在中国开展的开放标签、多中心、随机对照试验,旨在对比舒瑞基奥仑赛与现有标准治疗在CLDN18.2表达阳性(定义为≥40%肿瘤细胞膜染色强度≥2+)、至少二线治疗失败晚期G/GEJC患者中的有效性和安全性。筛选合格的受试者以2:1的比例随机分配至satri-cel组(接受satri-cel输注250×106/次,最多3次输注),或研究者选择治疗(TPC)组(包括紫杉醇、多西他赛、伊立替康、纳武利尤单抗或阿帕替尼)。TPC组受试者如出现疾病进展或药物不耐受,根据研究者判断可接受后续的CT041治疗。主要终点为独立评审委员会(IRC)评价的无进展生存期(PFS),关键次要终点为总生存期(OS)。
研究结果
截至2024年10月18日,本研究共156例受试者随机入组,即意向性治疗(ITT)人群,包括satri-cel组104例、TPC组52例。两组分别有88例(84.6%)和48例(92.3%)受试者接受了试验药物,即调整的意向性治疗(mITT)人群。其中TPC组共20例受试者后续接受了CT041输注。所有受试者既往均接受过至少二线治疗,satri-cel组和TPC组分别有26.9% vs 19.2%受试者接受过至少三线治疗;腹膜转移比例69.2% vs 59.6%。
在ITT人群中:基于IRC评价,satri-cel较对照组可显著延长PFS(mPFS 3.25个月 vs 1.77个月;HR 0.37,95% CI: 0.24-0.56;p<0.0001),达到本试验的主要终点。同时OS显示出明显的获益趋势(mOS 7.92个月 vs 5.49个月;HR 0.69,95%CI: 0.46-1.05;单侧p=0.0416)。即便在satri-cel组15.4%(16例)未能接受细胞输注、TPC组近40%(20例)后续接受satri-cel输注的情况下,CT041组患者死亡风险下降仍超过30%。
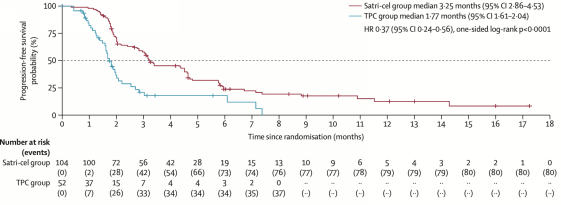
主要研究终点ITT人群PFS达阳性结果
在mITT即实际用药人群中:satri-cel组和TPC组基于IRC评价的mPFS为4.37个月 vs 1.84个月(HR 0.30,95%CI: 0.19-0.47);mOS为8.61个月 vs 5.49个月(HR 0.60,95%CI: 0.38-0.94)。因此在实际接受了细胞输注的患者中,CT041的治疗获益更加明显。
值得注意的是,TPC组20例接受satri-cel输注受试者的mOS达到9.20个月。satri-cel组和TPC组中所有接受satri-cel输注受试者(n=108)的mOS为9.17个月。
安全性方面,satri-cel组的整体耐受性良好,仅4例发生3级细胞因子释放综合症(CRS),无4-5级CRS。未发生免疫效应细胞相关神经毒性综合征(ICANS)事件。
研究结论
该研究是全球范围内实体瘤CAR-T领域首个开展的确证性随机对照试验,具有里程碑式意义。研究结果显示,在CLDN18.2表达阳性、至少二线治疗失败的G/GEJC患者中,舒瑞基奥仑赛(satri-cel)对比标准治疗可显著改善PFS,并展现出有临床意义的OS获益,同时具有可控的安全性特征。上述结果支持舒瑞基奥仑赛(satri-cel)成为晚期CLDN18.2阳性G/GEJC患者新的三线标准治疗方案。
齐长松教授在 ASCO 2025 大会口头报告现场接受媒体采访时也表示,“这些结果表明,CLDN18.2 CAR-T 疗法可能带来晚期胃癌治疗的范式转变,为实体瘤治疗领域带来几乎前所未有的细胞治疗新选择。”

















