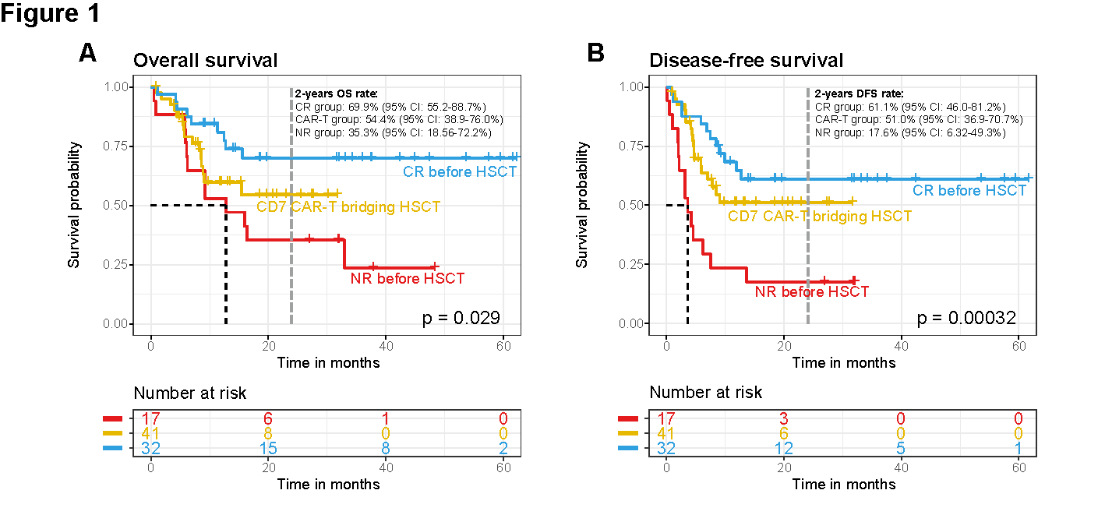
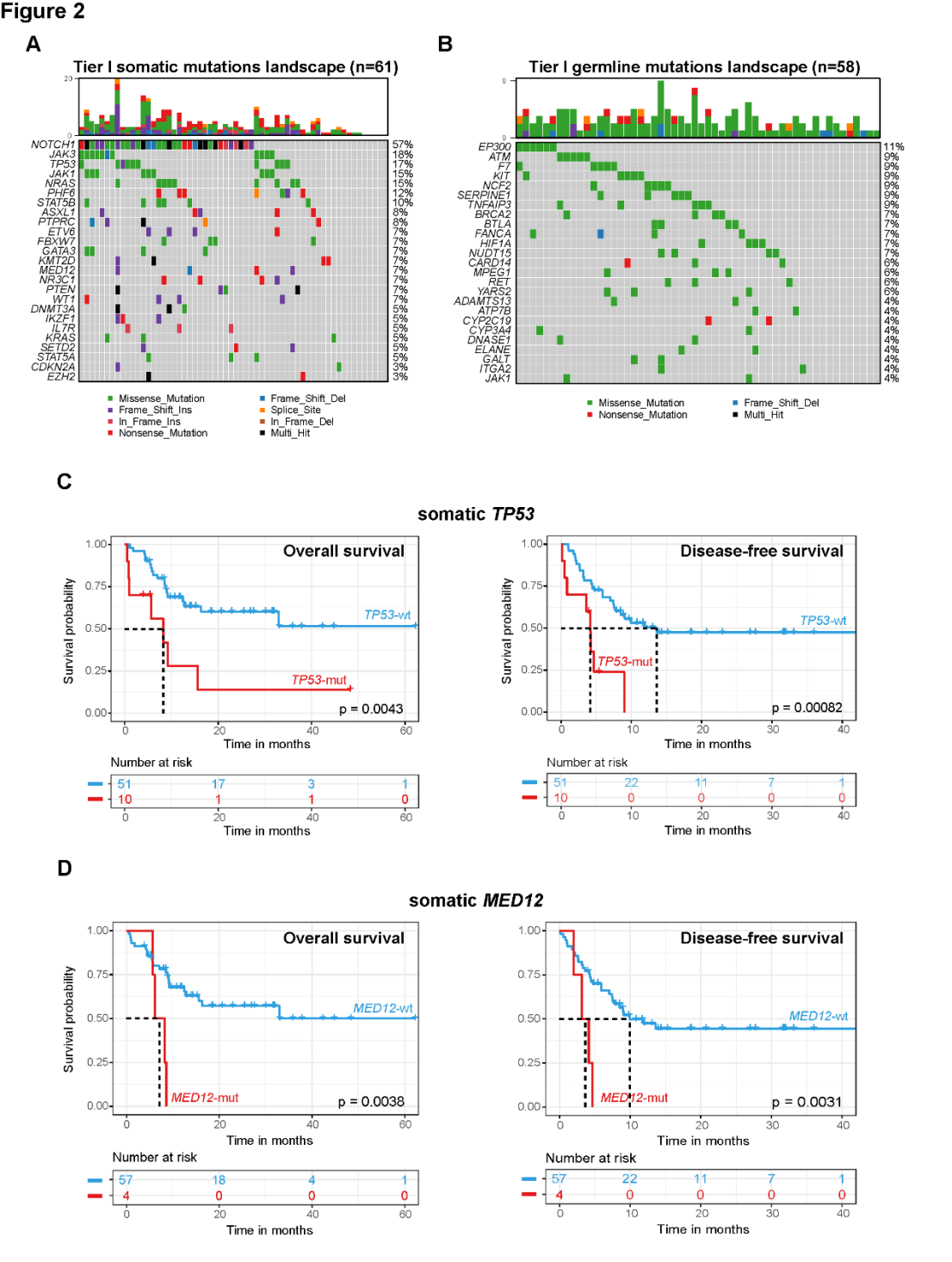
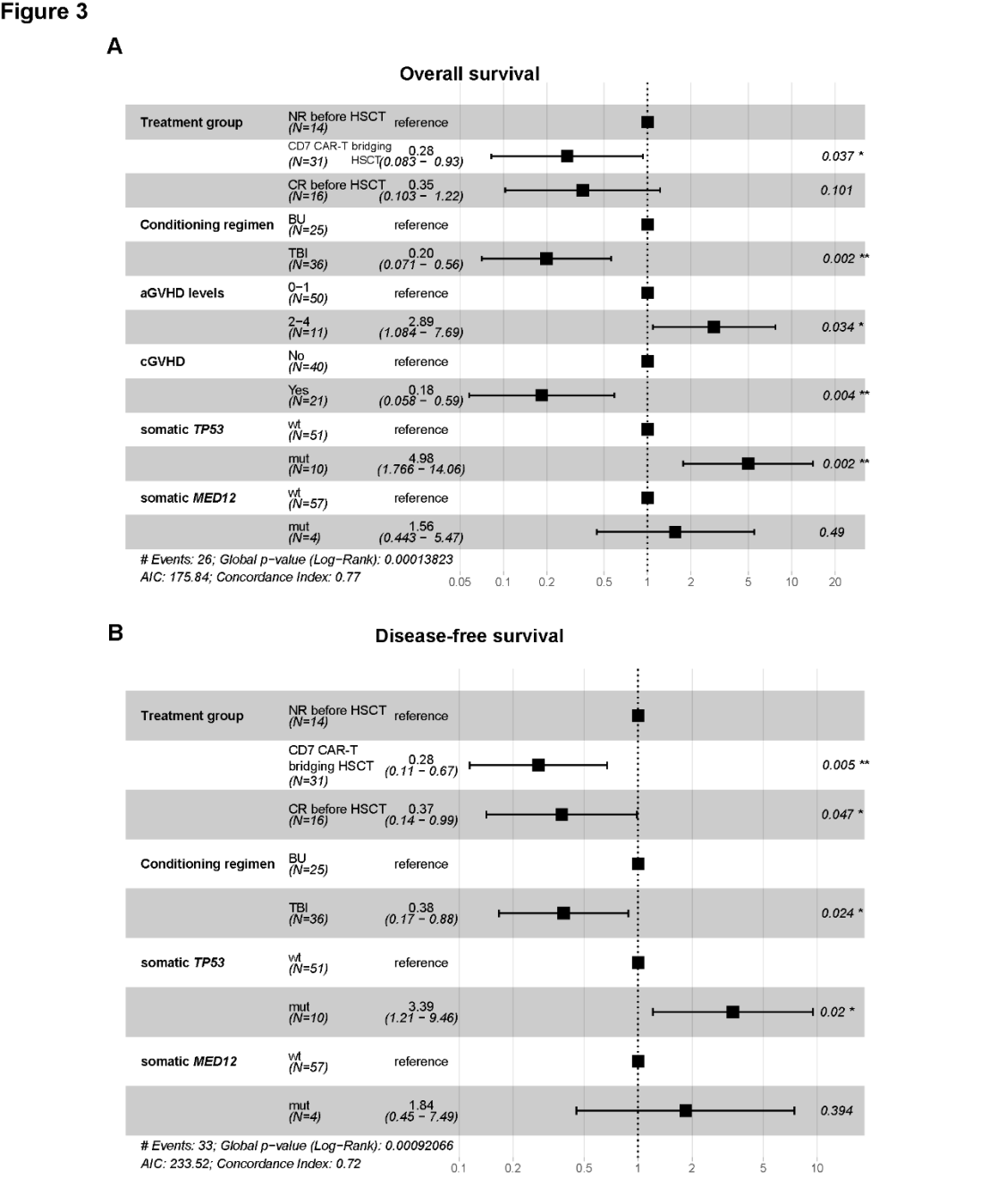
李智慧主任长期深耕血液内科临床与转化研究,是国内造血干细胞移植(HSCT)与移植并发症管理领域的青年专家。她在白血病、MDS、淋巴瘤、再生障碍性贫血、噬血细胞综合征(HLH)等疾病的移植治疗方面具有扎实而丰富的临床经验,尤其擅长CAR-T桥接异基因造血干细胞移植(allo-HSCT)在B-ALL、T-ALL/LBL、NK/T 淋巴瘤等高危疾病中的应用。
李主任同时在移植相关并发症(如GVHD、感染、HLH样反应等)的预防与处理方面积累了全面经验,能够为复杂与危重血液病患者制定精准、可实施的综合管理策略。
她在Frontiers in Immunology、Transplantation and Cellular Therapy、Frontiers in Oncology、Medicine、Journal of Pediatric Hematology/Oncology 国际期刊发表多篇SCI论文,并在ASH、EHA、EBMT、APBMT等国际权威学术会议累计发表口头报告与壁报交流20余次,具有广泛的国际学术影响力。